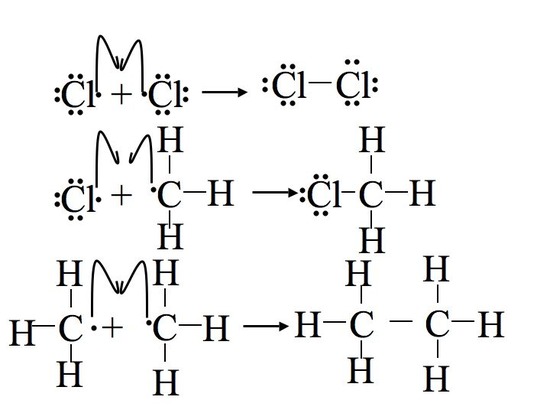
کلریناسیون متان
وقتی متان و گاز کلر را در تاریکی و در دمای اتاق، مخلوط شوند، واکنشی صورت نمی گیرد. قبل از این که واکنشی رخ دهد، مخلوط را باید تا 300 درجه ی سانتی گراد حرارت داد یا نور ماورای بنفش به آن تابید. یکی از دو محصول اولیه، کلرومتان است که در آن یک اتم کلر، جای یکی از هیدروژن های متان را می گیرد.
از دیگر فراورده های این واکنش، تشکیل هیدروژن کلرید می باشد. اگر CH3Cl به دست آمده در محیط قرار گیرد، می تواند با سایر کلر های موجود واکنش داده و فراورده هایی مانند CH2Cl2، CHCl3 و CCl4 تشکیل دهد:
اما اصلاً چرا باید این زنجیره از واکنش ها انجام شود؟ توجه کنید که میزان انرژی لازم برای شکستن یک پیوند C-H برابر با 1-105kcal.mol و انرژی لازم برای شکستن پیوند میان Cl-Cl، چیزی تقریباً برابر با 1-58kcal.mol می باشد.
در همین حین، تشکیل پیوند میان C-Cl، به انرژی حدودی 85kcal.mol-1 و تشکیل پیوند میان H-Cl به 103kcal.mol-1 نیاز دارد. با توجه به این انرژی های تشکیل و شکست، ΔHo برابر با 25kcal.mol-1– خواهد بود. یعنی واکنش گرمازا است و طبق آنچه از انرژی آزاد گیبس آموخته ایم، یک واکنش گرمازا، شرایط را برای خودبهخودی بودن، فراهم می کند.
اما این نکته را مد نظر داشته باشید که گرمازا بودن این واکنش، تنها شرایط را برای خودبهخودی بودن فراهم می کند اما باعث خودبهخود بودن واکنش نمی شود. به همین خاطر است که به دمایی نزدیک به 300 یا تابش موج (انرژی های فعالسازی واکنش) برای شروع واکنش نیاز داریم.
به طور کلی این واکنش در سه مرحله انجام می گیرد: شروع، پیشرفت و خاتمه. اجازه دهید تا به جزئیات به این مراحل بپردازیم:
مرحله ی اول: شروع واکنش
چون شکستن پیوند Cl-Cl انرژی کمتری لازم دارد، با حرارت دادن، ابتدا پیوند های Cl2 به صورت یکنواخت می شکنند و اتم های Cl را ایجاد می کنند.

با شروع شکستن Cl2 ها، مراحل بعدی در مکانیسم به صورت خود به خود انجام می گیرد و واکنش پیشرفت می نماید: یعنی این که هر چهار مرحله ی واکنش، بدون افزایش اتم های کلر بیشتر به صورت مداوم رخ می دهند.
مرحله ی دوم: پیشرفت واکنش
پیشرفت را می توان به دو مرحله ی جداگانه تقسیم نمود. در مرحله ی اول، یک اتم کلر به مولکول متان حمله می کند و یک اتم هیدروژن از آن می کند تا با آن واکنش دهد و HCl تشکیل شود، رادیکال متیل نیز از جمله فراورده های این واکنش است.
در مرحله ی دوم پیشرفت، رادیکال متیل با مولکول های Cl2 اولیه واکنش می دهد و CH3Cl به همراه یک رادیکال کلر تشکیل می شوند:

مرحله ی اول پیشرفت گرماگیر است. چون در آن باید 105kcal.mol-1+ انرژی جهت شکستن H-C صرف شود و درعوض تشکیل H-Cl گرماده بوده و 103kcal.mol-1– گرما تولید می کند. به همین خاطر ΔHo این مرحله مثبت است (2kcal.mol-1+).
مرحله ی دوم اما گرماده می باشد چراکه در آن باید 58kcal.mol-1+ انرژی داده شود تا Cl-Cl شکسته گردد اما تشکیل C-Cl، 85kcal.mol-1– گرما می دهد. به همین خاطر است که ΔHo این مرحله منفی است (27kcal.mol-1-).
از آن جایی که مرحله ی دوم پیشرفت، گرمازا شد، انرژی فعالسازی کمتری نیاز دارد و به همین خاطر سرعت انجام آن بسیار بالا است.

مرحله ی سوم: خاتمه
در این مرحله تمامی رادیکال های باقی مانده به هر شکل ممکن با یکدیگر ترکیب می شوند تا CH3Cl و Cl2 تهیه شود. حتی از واکنش دو رادیکال متیل نیز اتان به دست می آید:
 خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی
خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی