ساختار بنزن
بنزن جزو ساده ترین ترکیب های آلی معروف به هیدروکربن های حلقوی یا معطر است. مایعی بی رنگ وبا بوی تند مخصوص ، کمی سبک تر از آب که در دمای 80.1 درجه ی سانتی گراد به جوش می آید ودر 8.48 درجه ی سانتی گراد متبلور می شود. بسیار فرّاروقابل اشتعال است.
در اوایل قرن نوزدهم روغنی که برای روشن کردن خیابان های لندن وسایر شهرها مورد استفاده قرار می گرفت از چربی وال بدست می آمد. برای تعیین فرمول آن درسال1825 دانشمند انگلیسی، فاراده۱روغن وال را پیرولیز نمود و مایعی بی رنگ که فرمول تجربی آن CH بود را بدست آورد.
فرمول بنزن C6H6 است و آن را از تقطیر تدریجی قطرات زغال سنگ به دست می آورند.
بنزن در سال 1825 میلادی توسط میکائیل فاراده کشف شد واو آن را بیکربورهیدروژن نامید. هشت سال بعد میچرلیش این ماده را در محصولات تقطیر بنزوئیک اسید بدست آورد و نام بنزن را بر آن نهاد. ولی نام بنزول که لیبیگ وضع کرد جای آن را گرفت.
سرانجام فردریش آگوست ککوله۲در سال 1857 توانست ساختار حلقوی بنزن را شناسایی کند. او استدلال خودرا بر پایه ی سه فرض زیر قرار داد:
1- بنزن دارای فورمول C6H6 است.
2- همه ی هیدروژن های بنزن یکسان هستند.
3- هر کربن دارای چهار پیوند می باشد.
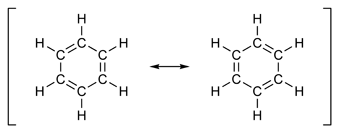
ککوله پیشنهاد خود را به این صورت اعلام کرد: شش اتم کربن بنزن برای تشکیل یک حلقه به یکدیگر متصل شده اند.بنزن مسطح است واسکلت کربنی آن دارای شش ضلع منظم می باشد. هیچ گونه شاهدی برای اینکه پیوندهای ساده و دوگانه یک در میان باشد وجود ندارد، بلکه تمام پیوندها یکسان و حد واسط ساده و دوگانه و طول آنها برابر 154 پیکومتر (pm) می باشد.
اتم های کربن در بنزن دارای ساختار مسطح و هیبرید sp2 می باشند. دو اوربیتال sp2 با دو اتم کربن دیگر در تشکیل حلقه ی شش گوشه شرکت نموده ، یک اوربیتال sp2 دیگر با اتم H پیوند می دهد. به این ترتیب یک اوبیتالp برای هر اتم کربن باقی می ماند که به طور عمود بر مولکول مسطح بنزن وبه فاصله ی مساوی از هم قرار گرفته و در نتیجه با هم موازی خواهند شد. هریک ار این اوربیتال ها می توانند به طور یکسانی با اوبیتال سمت راست وچپ خود همپوشانی کرده، پیوند پای (π ) تشکیل دهند ، به طوری که در بنزن به جای سه پیوند دوگانه مجزا ، یک پیوند پای شش مرکزی وجود دارد، ابر الکترونی پای(π ) بروی بنزن این پدیده را نشان می دهد.
وجود شش الکترون غیر مستقر بروی حلقه ی بنزن ، بطور یکنواخت بروی شش کربن حرکت می نمایند(رزونانس) و پایداری زیادی در حدود 40 کیلو کالری ( kj/mol 152 ) به بنزن داده اند، به طوری که علی رغم ساختار غیر اشباع در بنزن ، این مولکول حلقوی تمایلی به واکنش های افزایشی از خود نشان نمی دهد.
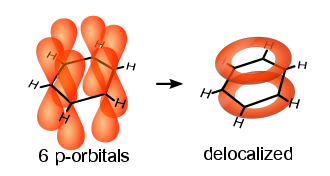
منابع:
کتاب شیمی آلی ولهارد-ویرایش پنجم- جلد دوم ،
کتاب حلقه های جادوئی در شیمی -جواد صفری
۱- پروفسور فاراده ، ( ۱۸۶۷-۱۷۹۱ ) ، انستیتو سلطنتی شیمی - لندن - انگلستان
۲- پروفسور فریدریش آگوست ککوله Friedrich August Kekule
 خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی
خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی