مباني شيمي آلي
تاریخچه
واژه غلط انداز " آلی " باقیمانده از روزگاری است که ترکیبهای شیمیایی
را ، بسته به این که از چه محلی منشاء گرفته باشند، به دو طبقه غیر آلی و
آلی تقسیم میکردند. ترکیبهای غیر آلی ، ترکیبهایی بودند که از مواد معدنی
بدست میآمدند. ترکیبات آلی ، ترکیبهایی بودند که از منابع گیاهی یا حیوانی
، یعنی از مواد تولید شده به وسیله ارگانیسمهای زنده بدست میآمدند.
در حقیقت تا حدود سال 1950، بسیاری از شیمیدانها تصور میکردند که ترکیبات آلی باید در ارگانیسم های زنده بوجود آیند و در نتیجه ، هرگز نمیتوان آنها را از مواد غیر آلی تهیه کرد. ترکیبهایی که از منابع آلی بدست می آمدند، یک چیز مشترک داشتند: همه آنها دارای عنصر کربن بودند. حتی بعد از آن که روشن شد این ترکیبها الزاما نباید از منابع زنده به دست آیند، بلکه میتوان آنها را در آزمایشگاه نیز تهیه کرد.
بهتر آن دیدند که برای توصیف آنها و ترکیبهایی مانند آنها ، همچنان از واژه آلی استفاده کنند. تقسیم ترکیبها به غیر آلی و آلی تا به امروز همچنان محفوظ مانده است.
در حقیقت تا حدود سال 1950، بسیاری از شیمیدانها تصور میکردند که ترکیبات آلی باید در ارگانیسم های زنده بوجود آیند و در نتیجه ، هرگز نمیتوان آنها را از مواد غیر آلی تهیه کرد. ترکیبهایی که از منابع آلی بدست می آمدند، یک چیز مشترک داشتند: همه آنها دارای عنصر کربن بودند. حتی بعد از آن که روشن شد این ترکیبها الزاما نباید از منابع زنده به دست آیند، بلکه میتوان آنها را در آزمایشگاه نیز تهیه کرد.
بهتر آن دیدند که برای توصیف آنها و ترکیبهایی مانند آنها ، همچنان از واژه آلی استفاده کنند. تقسیم ترکیبها به غیر آلی و آلی تا به امروز همچنان محفوظ مانده است.
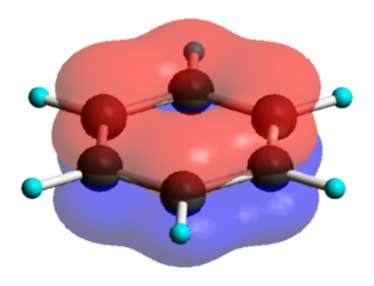
منابع مواد آلی
امروزه گرچه هنوز مناسبتر است که بعضی از
ترکیبهای کربن را از منابع گیاهی و حیوانی استخراج کنند، ولی بیشتر آنها
را میسازند. این ترکیبها را گاهی از اجسام غیر آلی مانند کربناتها و سیانیدها
میسازند، ولی اغلب آنها را از سایر ترکیبهای آلی بدست میآورند. دو منبع
بزرگ مواد آلی وجود دارد که ترکیبهای آلی ساده از آن بدست میآیند:
نفت و زغال سنگ؛ (هر دو منبع به معنی قدیمی خود ، آلیاند، زیرا فرآورده های تجزیه و فساد گیاهان و جانوران به شمار می آیند).
این ترکیبهای ساده بعنوان مواد ساختمانی اولیه مورد استفاده قرار میگیرند و با کمک آنها میتوان ترکیبهایی بزرگتر و پیچیدهتر را تهیه کرد. با نفت و زغال سنگ بعنوان سوختهای فسیلی ، باقیمانده از هزاران سال و تجدید نشدنی ، آشنا هستیم. این منابع ، بویژه نفت ، بمنظور تامین نیازهای پیوسته رو به افزایش ما به انرژی ، با سرعتی نگرانکننده مصرف میشوند.
امروزه ، کمتر از ده درصد نفت مصرفی در تهیه مواد شیمیایی ، بکار گرفته میشود. بیشتر آن برای تامین انرژی بسادگی سوزانده میشود. خوشبختانه ، منابع دیگر انرژی ، مانند خورشیدی ، زمین گرمایی ، باد ، امواج ، جزر و مد ، انرژی هستهای نیز وجود دارد.
نفت و زغال سنگ؛ (هر دو منبع به معنی قدیمی خود ، آلیاند، زیرا فرآورده های تجزیه و فساد گیاهان و جانوران به شمار می آیند).
این ترکیبهای ساده بعنوان مواد ساختمانی اولیه مورد استفاده قرار میگیرند و با کمک آنها میتوان ترکیبهایی بزرگتر و پیچیدهتر را تهیه کرد. با نفت و زغال سنگ بعنوان سوختهای فسیلی ، باقیمانده از هزاران سال و تجدید نشدنی ، آشنا هستیم. این منابع ، بویژه نفت ، بمنظور تامین نیازهای پیوسته رو به افزایش ما به انرژی ، با سرعتی نگرانکننده مصرف میشوند.
امروزه ، کمتر از ده درصد نفت مصرفی در تهیه مواد شیمیایی ، بکار گرفته میشود. بیشتر آن برای تامین انرژی بسادگی سوزانده میشود. خوشبختانه ، منابع دیگر انرژی ، مانند خورشیدی ، زمین گرمایی ، باد ، امواج ، جزر و مد ، انرژی هستهای نیز وجود دارد.
زیست توده
چگونه و در کجا میتوانیم منبع دیگری از
مواد اولیه آلی پیدا کنیم؛ بی شک باید به جایی روی آوریم که مبدا اولیه
سوختهای فسیلی است، یعنی زیست توده biomass ، ولی این بار بطور مستقیم و
بدون دخالت هزاران سال. زیست توده ، تجدید شدنی است، براحتی مورد استفاده
قرار میگیرد و میتواند تا موقعی که بر روی این سیاره زندگی میکنیم،
تداوم داشته باشد.
در ضمن عقیده بر این است که نفت خیلی گرانبهاتر از آن است که سوزانده شود.
در ضمن عقیده بر این است که نفت خیلی گرانبهاتر از آن است که سوزانده شود.
ویژگی ترکیبات کربن
براستی چه ویژگی خاصی در ترکیبهای کربن
وجود دارد که لازم است آنها را از ترکیبهای یکصد و چند عنصر دیگر جدول
تناوبی جدا کنیم؟ دست کم ، بخشی از پاسخ چنین است: ترکیبهای بسیار زیادی از
کربن وجود دارد و مولکول آنها میتواند بسیار بزرگ و بسیار پیچیده باشد.
شمار ترکیبهای کربندار ، چندین برابر ترکیبهایی است که کربن ندارند. این
ترکیبهای آلی را به خانواده هایی تقسیم میکنند که معمولا در ترکیبهای
غیرآلی ، همانندی برایشان وجود ندارد.
بعضی از مولکولهای شناخته شده آلی ، هزاران اتم دارند و آرایش اتمها در مولکولهای نسبتا کوچک ممکن است بسیار پیچیده باشد. یکی از دشواریهای اساسی شیمی آلی ، یافتن چگونگی آرایش اتمها در مولکولها ، یعنی تعیین ساختار این ترکیبهاست.
بعضی از مولکولهای شناخته شده آلی ، هزاران اتم دارند و آرایش اتمها در مولکولهای نسبتا کوچک ممکن است بسیار پیچیده باشد. یکی از دشواریهای اساسی شیمی آلی ، یافتن چگونگی آرایش اتمها در مولکولها ، یعنی تعیین ساختار این ترکیبهاست.
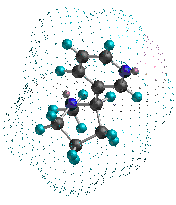
واکنشها در شیمی آلی
راههای زیادی برای خرد کردن مولکولهای
پیچیده یا نوآرایی آنها بمنظور تشکیل مولکولهای تازه وجود دارد. راههای
زیادی برای افزودن اتمهای دیگر به این مولکولها یا جانشین کردن اتمهای تازه
به جای اتمهای پیشین وجود دارد. بخشی ار شیمی آلی صرف دانستن این مطلب
میشود که این واکنشها چه واکنشهایی هستند، چگونه انجام میشوند و چگونه
میتوان از آنها در سنتز ترکیبهای مورد نیاز استفاده کرد.
گستره اتصال اتمهای کربن در ترکیبات کربن
اتمهای کربن میتوانند به یکدیگر متصل
شوند. گستره اتصال آنها به هم ، به اندازهای است که برای اتمهای هیچ یک از
عناصر دیگر ممکن نیست. اتمهای کربن میتوانند زنجیرهایی به طول هزارها اتم
، یا حلقههایی با ابعاد گوناگون تشکیل دهند. این زنجیرها ممکن است
شاخهدار و دارای پیوندهای عرضی باشند. به اتمهای کربن در این زنجیرها و
حلقه ها ، اتمهای دیگری بویژه هیدروژن ، همچنین فلوئور ، کلر ، برم ، ید ،
اکسیژن ، نیتروژن ، گوگرد ، فسفر و سایر اتمها متصل میشوند. سلولز ،
کلروفیل و اکسی توسین مثالهایی از این دستند.
هر آرایش متفاوتی از اتمها با یک ترکیب معین تطبیق میکند و هر ترکیب دارای مجموعه ای از ویژگیهای شیمیایی و فیزیکی مخصوص به خود است. شگفتانگیز نیست که امروزه بیش از ده میلیون ترکیب کربن میشناسیم و این که بر این تعداد ، همه ساله نیم میلیون افزوده میشود. همچنین شگفت انگیز نیست که مطالعه و بررسی شیمی آنها به تخصصی ویژه نیاز دارد.
هر آرایش متفاوتی از اتمها با یک ترکیب معین تطبیق میکند و هر ترکیب دارای مجموعه ای از ویژگیهای شیمیایی و فیزیکی مخصوص به خود است. شگفتانگیز نیست که امروزه بیش از ده میلیون ترکیب کربن میشناسیم و این که بر این تعداد ، همه ساله نیم میلیون افزوده میشود. همچنین شگفت انگیز نیست که مطالعه و بررسی شیمی آنها به تخصصی ویژه نیاز دارد.
تکنولوژی و شیمی آلی
شیمی آلی ، زمینهای است که از دیدگاه
تکنولوژی اهمیتی فوقالعاده دارد. شیمی آلی شیمی رنگ و دارو ، کاغذ و مرکب ،
رنگینه ها و پلاستیکها ، بنزین و لاستیک چرخ است. شیمی آلی ، شیمی غذایی
است که میخوریم و لباسی است که میپوشیم.
زیست شناسی و شیمی آلی
شیمی آلی در زیست شناسی و پزشکی نقش اساسی
برعهده دارد. گذشته از آن ، ارگانیسم های زنده ، بیشتر از ترکیبهای آلی
ساخته شده اند. مولکولهای "زیست شناسی مولکولی" همان مولکولهای آلی هستند.
زیست شناسی در سطح مولکولی ، همان شیمی آلی است.
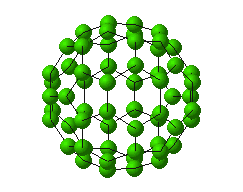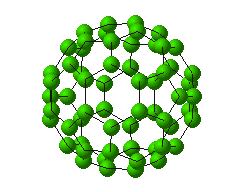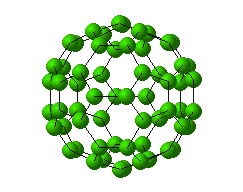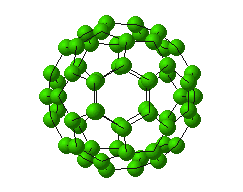 |
|
|
عصر کربن
اگر بگوییم که در عصر کربن زندگی می کنیم، دور از حقیقت نیست. هر روز ، روزنامهها توجه ما را به ترکیبهای کربن جلب میکنند: کلسترولو چربیهای سیرنشده چند عاملی ، هورمونهای رشد و استروئیدها ، حشره کشها و فرومونها ، عوامل سرطانزا و عوامل شیمیدرمانی ، DNA و ژنها. بر سر نفت ، جنگها در گرفته است.
دو فاجعه اسفانگیز ما را تهدید میکنند، هر دو از تجمع ترکیبهای کربن در اتمسفر ناشی میشوند: از بین رفتن لایه اوزون که بیشتر ناشی از کلرو فلوئورو کربنهاست و اثر گلخانهای از متان ، کلروفلوئوروکربنها و بیش از همه ، دیاکسید کربن سرچشمه میگیرد. شاید کنایه بر همین مطلب است که نشریه علوم ، برای سال 1990، بعنوان مولکول سال ، الماس را که یکی از شکلهای آلوتروپی کربن است، برگزیده.
خبر دیگر ، کشف آلوتروپ جدید کربن C60 (باک منیستر فولرن) است که چنین هیجانی در جهان شیمی از زمان " ککوله " تاکنون دیده نشده بود.
آلکانها
دو فاجعه اسفانگیز ما را تهدید میکنند، هر دو از تجمع ترکیبهای کربن در اتمسفر ناشی میشوند: از بین رفتن لایه اوزون که بیشتر ناشی از کلرو فلوئورو کربنهاست و اثر گلخانهای از متان ، کلروفلوئوروکربنها و بیش از همه ، دیاکسید کربن سرچشمه میگیرد. شاید کنایه بر همین مطلب است که نشریه علوم ، برای سال 1990، بعنوان مولکول سال ، الماس را که یکی از شکلهای آلوتروپی کربن است، برگزیده.
خبر دیگر ، کشف آلوتروپ جدید کربن C60 (باک منیستر فولرن) است که چنین هیجانی در جهان شیمی از زمان " ککوله " تاکنون دیده نشده بود.
آلکانها
مقدمه
بعضی از ترکیبهای آلی ، فقط شامل دو عنصر هیدروژن و کربن میباشند و در نتیجه آنها را هیدروکربن مینامند. با تکیه بر ساختار ، هیدروکربنها را به دو گروه و طبقه اصلی یعنی آلیفاتیک و آروماتیک تقسیم میکنند. هیدروکربنهای آلیفاتیک خود به چند خانواده: آلکانها ، آکینها و همانندهای حلقوی آنها (سیکلوآلکانها و…) تقسیم میشوند.متان ، ساده ترین عضو خانواده آلکانها
متان ، CH4 ، ساده ترین عضو خانواده آلکانها و همچنین یکی از ساده ترین ترکیبهای آلی است.ساختار متان
هر یک از چهار اتم هیدروژن بوسیله پیوند کووالانسی ، یعنی با یک جفت الکترون اشتراکی به اتم کربن متصل شده است. وقتی کربن به چهار اتم دیگر متصل باشد، اوربیتالهای پیوندی آن (اوربیتالهای sp3 که از اختلاط یک اوربیتال s و سه اوربیتال p تشکیل شدهاند) ، به سوی گوشههای چهار وجهی جهت گیری کردهاند.این آرایش چهار وجهی ، آرایشی است که به اوربیتالها اجازه میدهد تا سر حد امکان از یکدیگر فاصله بگیرند. برای اینکه همپوشانی این اوربیتالها با اوربیتال کروی اتم هیدروژن به گونه ای موثر صورت پذیرد و در نتیجه ، پیوند محکمتری تشکیل شود، هر هسته هیدروژن باید در یک گوشه این چهار وجهی قرار بگیرد.
ساختار چهار وجهی متان بوسیله پراش الکترونی که آرایش اتمها را در این نوع مولکولهای ساده به روشنی نشان میدهد، تایید شده است. بعد شواهدی که شیمیدانها را خیلی پیش از پیدایش مکانیک کوانتومی REDIRECT (نام صفحه) یا پراش الکترونی d ، به پذیرش این ساختار چهار وجهی رهنمون شد، بررسی خواهیم کرد.
ما به طور معمول ، متان را با یک خط کوتاه برای نمایش هر جفت الکترون مشترک بین کربن و هیدروژن نشان خواهیم داد. برای آنکه توجه خود را بر روی الکترونها بطور انفرادی متمرکز کنیم، گاهی ممکن است یک جفت الکترون را بوسیله یک جفت نقطه نشان دهیم. سرانجام ، وقتی بخواهیم شکل واقعی مولکول را نمایش دهیم، از فرمولهای سه بعدی استفاده میکنیم.
خواص فیزیکی متان
واحد ساختار این ترکیب غیر یونی ، مولکول است، چه جامد باشد، چه مایع و چه گاز. به علت اینکه مولکول متان بسیار متقارن است، قطبیتهای انفرادی پیوندهای کربن – هیدروژن ، یکدیگر را خنثی میکنند، در نتیجه کل مولکول غیر قطبی است. نیروهای جاذبه موجود میان این مولکولها غیر قطبی، به نیروهای واندروالسی محدود میشوند؛این نیروهای جاذبه ، در مورد این مولکولهای کوچک ، باید در مقایه با نیروهای قدرتمند موجود بین مثلا یونهای سدیم و کلرید ضعیف باشند. بنابراین ، از اینکه به آسانی میتوان بوسیله انرژی گرمایی ، بر این نیروهای جاذبه فایق آمد، بطوریکه ذوب شدن و جوشیدن در دمای پایین صورت بگیرد، تعجب نخواهیم کرد: دمای ذوب در 183- درجه سانتیگراد و دمای جوش در 161,5- درجه سانتیگراد قرار دارد. (این مقادیر را با مقادیر مربوط در مورد سدیم کلرید: یعنی دمای ذوب 801 درجه سانتیگراد و دمای جوش 1413درجه سانتیگراد مقایسه کنید.) در نتیجه ، متان در دماهای معمولی یک گاز است.
متان ، بیرنگ است و وقتی مایع شود، سبکتر از آب است (چگالی نسبی آن 0,4 است). موافق با قاعده تجربی که میگوید: «همجنس در همجنس حل میشود» ، متان فقط کمی در آب انحلال پذیر است، ولی در مایعات آلی مانند بنزین ، اتر و الکل بسیار حل میشود. از نظر خواص فیزیکی ، متان الگویی برای سایر اعضا خانواده آلکانهاست.
منبع متان
متان ، فرآورده پایانی تجزیه غیر هوازی (بدون هوا) گیاهان ، یعنی شکستن بعضی از مولکولهای بسیار پیچیده است. همچنین یکی از اجزاء اصلی (بیش از 97%) گاز طبیعی است. متان همان گاز قابل احتراق و منفجر شونده معادن زغال سنگ است و میتوان خروج حبابهای آن را به عنوان گاز مرداب در سطح مردابها مشاهده کرد. اگر متان بسیار خالص لازم داشته باشیم، میتوان آن را بوسیله تقطیر جزء به جزء از سایر اجزاء تشکیل دهنده گاز طبیعی (که بیشتر آلکانها هستند) جدا کرد.البته بیشتر گاز طبیعی ، بدون خالص سازی ، به عنوان سوخت مصرف میشود.
ساختار اتان
از نظر اندازه C2H6 بعد از متان قرار میگیرد. اگر اتمهای این مولکول را با رعایت قاعده ای که میگوید برای هیدروژن یک پیوند (یک جفت الکترون) و برای کربن ، چهار پیوند (چهاز جفت الکترون) ، بوسیله پیوندهای کووالانسی به یکدیگر متصل کنیم، به ساختار زیر دست مییابیم: CH3-CH3.هر کربن به سه هیدروژن و یک کربن دیگر متصل است و چون هر اتم به چهار اتم دیگر متصل است، اوربیتالهای پیوندی ان (اوربیتالهای sp3) بهسوی گوشههای چهار وجهی جهت گرفتهاند. در اینجا نیز مانند مورد متان ، پیوندهای کربن- هیدروژن از همپوشانی این اوربیتالهای sp3 با اوربیتالهای s هیدروژنها بوجود آمدهاند. پیوند کربن- کربن از همپوشانی دو اوربیتال sp3 نتیجه شده است.
توزیع الکترونها در پیوندهای کربن- هیدروژن و کربن- کربن بطور کلی یکسان است، یعنی در حول خط متصلکننده هستهها به هم ، حالتی استوانهای و متقارن دارد: این پیوندها را به علت شکل مشابهی که دارند، پیوند σ (پیوند سیگما) مینامند.
بنابراین ، زوایای پیوندی و طول پیوندهای کربن- هیدروژن باید خیلی شبیه به متان ، یعنی به ترتیب در حدود 109,5درجه و 1,1 آنگستروم باشند.
پراش الکترونی و بررسیهای طیفبینی از هر نظر این ساختار را تایید کرده و برای مولکول اتان این اندازهها را بدست دادهاند. زوایای پیوندی 109,5 ، طول 1,1 برای C-H ، طول 1,53 برای C-C . بررسیهای مشابه نشان دادهاند که این مقادیر ، با کمی انحراف ، از ویژگیهلی اختصاصی پیوندهای کربن- هیدروژن و کربن- کربن و زوایای پیوندی در آلکانها بشمار میروند.
خواص فیزیکی آلکانها
خواص فیزیکی آلکانها از همان الگوی خواص فیزیکی متان پیروی میکند و با ساختار آلکانها سازگار است. یک مولکول آلکان فقط بوسیله پیوندهای کووالانسی برپا نگه داشته شده است. این پیوندها یا دو اتم از یک نوع را بهم متصل میکنند و در نتیجه ، غیر قطبیاند، یا دو اتم را که تفاوت الکترونگاتیوی آنها بسیار کم است، به یکدیگر ربط میدهند و در نتیجه قطبیت آنها کم است. به علاوه ، این پیوندها به طریقی بسیار متقارن جهت گرفتهاند، بطوری که این قطبیهای پیوندی نیز یکدیگر را خنثی میکنند.در نتیجه یک مولکول آلکان یا غیر قطبی است یا قطبیت بسیار ضعیفی دارد. نیروهایی که مولکولهای غیر قطبی را گرد هم نگه میدارند (نیروهای واندروالسی) ضعیف هستند و گستره بسیار محدودی دارند. این نیروها فقط بین بخشهایی از مولکولهای مختلف که با یکدیگر در تماس نزدیک باشند، یعنی بین سطوح مولکولها ، عمل میکنند. بنابراین در یک خانوده معین ، انتظار داریم که هر اندازه مولکول بزرگتر باشد و در نتیجه سطح تماس آنها بیشتر باشد، نیروهای بین مولکولی نیز قویتر باشند.
دمای جوش و ذوب با افزایش شمار اتمهای کربن ، زیاد میشود. فرایند جوشیدن و ذوب شدن ، مستلزم فایق آمدن بر نیروهای بین مولکولی در یک مایع و یک جامد است. دمای جوش و دمای ذوب بالا میرود، زیرا این نیروهای بین مولکولی با بزرگ شدن مولکولها افزایش مییابند.
منبع صنعتی آلکانها
منبع صنعتی آلکانها ، نفت و گاز طبیعی همراه آن است. ترکیبهای آلی پیچیده که روزگاری سیستمهای زنده گیاهان و جانوران را تشکیل میدادند، در اثر فضارهای زمین شناختی ، طی میلیونها سال ، به مخلوطی از آلکانها که از نظر اندازه ، شامل یک کربن تا 30 تا 40 کربن هستند، تبدیل شدهاند. سیکلوآلکانها نیز که در صنعت نفت به نفتنها شهرت دارند و به ویژه در نفت کالیفرنیا فراوان یافت میشوند، همراه با آلکانها بوجود آمدهاند.سوخت فسیلی دیگر ، یعنی زغال سنگ ، منبع بالقوه دیگر آلکانهاست. روشهایی برای تبدیل زغال سنگ از راه هیدروژن دار کردن به بنزین و سوخت کوره و همچنین تبدیل به گاز سنتز به منظور جبران کمبود گاز طبیعی ابداع شده است.
آلکنها
| آلکنها ، دسته بزرگی از هیدروکربنها را شامل می شوند که به هیدروکربنهای غیر اشباع (unsaturated) موسومند. تعداد هیدروژنهای این ترکیبات ، کمتر از آلکنهای هم کربن است. آلکنها ممکن است یک یا چند پیوند دوگانه مجزا و دور از هم و یا مزدوج داشته باشند. |
ساختمان پیوند دوگانه کربن- کربن در آلکنها
اتیلن
اتیلن کوچکترین عضو خانوده آلکنها و به فرمول C2H4 میباشد که دو اتم هیدروژن کمتر از آلکان همکربن (اتان) دارد. ما در اینجا به بررسی ساختمان اتیلن میپردازیم تا با ساختار ترکیبات اشباع نشده آشنا شویم. بررسی ساختمان اتیلن به طریق کوانتوم مکانیکی نشان داده است که کربن ، برای اینکه در ساختمان اتیلن شرکت نماید، لازم است که با استفاده از اوربیتالهای 2s و دو اوربیتال 2p خود ، سه اوربیتال هیبریدی یکسان بوجود آورد که این اوربیتالهای هیبریدی ، در یک سطح قرار میگیرند، بنحوی که اتم کربن ، در مرکز یک مثلث قرار گرفته و زوایای بین اوربیتالهای هیبریدی ، 120 درجه تخمین زده شده است.هرگاه ما چهار اتم هیدروژن و دو اتم کربن sp2 را کنار هم مرتب کنیم، شکلی ایجاد میشود که در آن ، هر اتم کربن در سه پیوند σ (سیگما) شرکت دارد. برای رسیدن به کربن به حالت اکتت ، لازم است که سومین اوربیتال 2p اتمهای کربن همپوشانی کرده ، پیوند ایجاد کنند. این پیوند که از همپوشانی اوربیتالهای p کربن ایجاد میشود، از نظر شکل و انرژی ، با پیوند σ متفاوت میباشد و به پیوند π موسوم است که از دو قسمت تشکیل شده است.
یک ابرالکترونی در بالای سطح مولکول و ابر الکترونی دیگر ، در پایین سطح قرار میگیرد. وقتی این ساختمان میتواند انجام شود که تمام اتمهای شرکت کننده در ساختمان اتیلن در یک سطح قرار گیرند. پس مولکول اتیلن لازم است یک مولکول مسطح باشد. مسطح بودن مولکول اتیلن بوسیله روشهای طیف سنجی و پراش الکترونی مورد تایید قرار گرفته است.
پروپن
پروپن به فرمول C3H6 ، CH3-CH=CH2 ، دومین عضو خانواده آلکنها میباشد که سه اتم کربن با 6 اتم هیدروژن به هم متصل شدهاند.بوتن
بوتن به فرمول C4H8 عضو بعدی این خانوده است که برای آن ، چند نوع آرایش میتوان در نظر گرفت که در آنها ، چهار اتم کربن با هشت اتم هیدروژن طوری قرار بگیرند که قانون اکتت رعایت شده باشد. بوتن به ظاهر دارای سه ایزومر میباشد، ولی مطالعات تجربی نشان داده است که برای آلکنی به فرمول C4H8 چهار ساختمان فیزیکی کاملا متفاوت وجود دارد.روش آیوپاک برای نامگذاری آلکنها
در روش آیوپاک ، نامگذاری آلکنها با رعایت نکات زیر انجام میشود:- بلندترین زنجیری را که پیوند دوگانه کربن- کربن در آن قرار گرفته باشد، انتخاب میکنیم.
- زنجیر اصلی را به نحوی شماره گذاری میکنیم که اولین کربن روی پیوند دوگانه ، کوچکترین شماره را به خود بگیرد. (این روش تنها در مورد مشتقات کربن و هیدروژن صادق است. در نامگذاری الکل های اتیلنی و اسیدها و استرهای اتیلنی و برخی مشتقات دیگر ، اولویت با عوامل الکل ، اسید و استر میباشد.)
- شماره کربنهایی را که استخلافها در روی آنها قرار گرفتهاند، مشخص میکنیم.
- اگر قرار باشد ایزومرهای هندسی ماده مشخص گردد، در اول نام ماده از پیشوند cis و trans یا E و Z استفاده میکنیم.
خواص فیزیکی آلکنها
بطور کلی ، خواص فیزیکی آلکنها مشابه آلکانهاست. آلکنها در حلالهای غیرقطبی مانند اتر ، کلروفرم و دیکلرو متان محلول ولی در آب نامحلول میباشند و سبکتر از آب نیز میباشند. نقطه جوش آلکنها با افزایش تعداد کربنها افزایش مییابد. بجز آلکنهای کوچک ، نقطه جوش آلکنها به ازای افزایش یک اتم کربن بین 20 تا 30 درجه سانتیگراد افزایش مییابد. همانند آلکانها ، شاخهدار شدن آلکنها موجب کاهش نقطه جوش میشود.آلکنها اندکی قطبیتر از آلکانها هستند این قطبیت اندک در اثر خصلت الکترون دهی و الکترون گیری گروهها ایجاد میگردد. وقتی روی آلکنها ، گروههای القایی با قدرت بیشتر قرار میگیرد، ممان دو قطبی اندکی افزایش مییابد.
تهیه آلکنها
از طریق هیدروهالوژن زدایی از هالیدهای آلکیل
هیدروهالوژن زدایی ، واکنشی است که طی آن ، از یک مولکول هالید آلکیل یک مولکول هالید هیدروژن (یک اتم هیدروژن از یک کربن و یک اتم هالوژن از کربن مجاور) برداشته میشود. این واکنش بسته به ساختمان و شرایط محلول میتواند از طریق دو مکانیسم متفاوت E2 و E1 انجام بگیرد.تهیه آلکنها از طریق هالوژن ردایی از α- دی بروموآلکان
اگر دو اتم هالوژن در روی یک اتم کربن قرار گرفته باشند، ماده را دیهالوژنه دوقلو geminal مینامند و اگر دو هالوژن در روی دو اتم کربن مجاور قرار گرفته باشند، vicinal خوانده میشود. از واکنش مشتقات α- دی برومو با پودر روی در اسید استیک و طی یک واکنش هالوژن زدایی ، آلکن مربوطه تولید میشود. در این واکنش ، هر دو اتم برم آزاد میشود و آلکن تشکیل میگردد. روی در اسید استیک نقش احیا کننده را بازی میکند. روی اکسید میشود و هالید الکیل احیا میشود.تهیه آلکنها از طریق آبگیری از الکلها
یکی از بهترین روشهای تهیه آلکنها ، آبگیری از الکلهاست. واکنش آبگیری از الکل در حضور کاتالیزورهای اسیدی ، معمولا برگشت پذیر بوده ، سرعت کمتری دارد. لذا جهت جلوگیری از واکنش برگشتی و برای تکمیل واکنش ، آلکن تولید شده را از محیط واکنش خارج میکنند. با توجه به این که نقطه جوش آلکنها ، پایینتر از نقطه جوش الکلهای مربوطه میباشد، لذا این عمل بسهولت انجام میگیرد. در واکنشهای آبگیری از الکلها ، معمولا از اسید سولفوریک یا اسید فسفریک غلیظ استفاده میشود.واکنشهای شیمیایی آلکنها
اگر بخواهیم واکنشهای شیمیایی آلکنها را پیشبینی نماییم، لازم است ابتدا فعالیت پیوند π در آلکنها را مورد مطالعه قرار دهیم و تاثیر پیوند دوگانه روی گروههای آلکیل مجاور و برعکس را خوب بدانیم. با مطالعه واکنشهای اختصاصی پیوند دوگانه ، قادر خواهیم بود تا واکنشهای اختصاصی خیلی از آلکنها و واکنشگرهای دیگر را پیشبینی نماییم.بطور کلی دو نوع واکنش در روی آلکنها انجام پذیر میباشد. دسته اول آنهایی هستند که در روی پیوند π انجام میگیرند و لذا پیوند π از بین میرود و پیوندهای جدید تشکیل میگردد. واکنشهای دسته دوم ، واکنشهایی هستند که در محلولهای دیگری که ارتباط خاصی با پیوند دوگانه دارند، اتفاق میافتند. مثل گروههای آلکیل و یا عوامل دیگری که به کربنهای sp2 متصل میباشند.
آلکینها
| هرگاه ترکیب آلی حاوی پیوند سه گانه کربن به کربن باشد، آلکین نامیده میشود. استیلن با فرمول C2H2 کوچکترین عضو این خانوده میباشد و به همین دلیل آلکینها را ترکیبات استیلنی یا استیلنهای استخلافدار میگویند. همانطوریکه ساختمان استیلن نشان میدهد، برای این که دو اتم کربن و دو اتم هیدروژن بهم وصل شوند و مولکول کاملی را تولید نماید، لازم است که کربنها با هیبرید sp و از طریق پیوند سهگانه (یک پیوند سیگما و دو تا پیوند پی) به یکدیگر وصل شوند. |
تقسیم بندی استیلنها
استیلنهای حقیقی یا انتهایی (terminal acetylenes)
به ترکیباتی از این گروه اطلاق میشود که حداقل یک اتم هیدروژن متصل به کربن sp در آنها وجود داشته باشد. مثلا پروپن (متیل استیلن) یک استیلن حقیقی است. به همین ترتیب ، فنیل استیلن و ترسیوبوتیل استیلن از استیلنهای حقیقی میباشند.استیلنهای داخلی (internal acetylenes)
هرگاه پیوند سه گانه کربن به کربن درجایی از مولکول قرار گرفته باشد که کربنهای با هیبرید sp به استخلاف متصل باشند، استیلنی را داخلی مینامند، مثل دیمتیل استیلن ، دیفنیل استیلن و دیترسیوبوتیل استیلن.نامگذاری آلکینها
آلکینها با چند روش نامگذاری میشوند:در نامگذاری معمولی ، آلکینها به عنوان مشتقات استیلنی نامگذاری میشوند. معمولا برای نامگذاری استیلنهای کوچک از این روش استفاده میشود. روش جامع برای نامگذاری آلکینها روش (IUPAC) است و اصول آن ، مشابه نامگذاری آلکنهاست و با رعایت نکات زیر انجام میشود:
- طولانی ترین زنجیری را که پیوند سه گانه در آن قرار دارد، مشخص و
کربنهای زنجیر اصلی را از طرفی شماره گذاری میکنیم که اولین کربن پیوند
سهگانه شماره کوچکتری را داشته باشد.
- نام گروهها و شماره کربن محل آنها را معین و به ترتیب الفبای انگلیسی مرتب میکنیم.
- با ذکر شماره کربن محل پیوند سهگانه و تغییر نام آخر زنجیر از ane به yne نامگذاری به پایان میرسد.
ساختمان استیلن
اتین یا استیلن ، کوچکترین عضو خانوده بزرگ آلکینها (استیلنیها) میباشد. به طریق کوانتوم مکانیکی ، اگر بخواهیم با دو اتم هیدروژن ، مولکولی را ایجاد کنیم، لازم است کربنها با یک پیوند سهگانه به یکدیگر متصل شوند. برای ایجاد مولکولی اتمهای کربن باید هیبرید sp داشته باشند. یکی از این اوربیتالهای هیبریدی به کربن و دیگری به هیدروژن متصل و اوربیتالهای py و Pz نیز دو پیوند π را ایجاد میکنند.با شناختی که از دو پیوند دوگانه کربن به کربن و کربن به هیدروژن آلکنها داریم، انتظار میرود که طول پیوند سه گانه کربن- کربن و کربن- هیدروژن در استیلنیها کوتاهتر باشد. طول پیوند سه گانه کربن- کربن 1,20 آنگستروم و کربن- هیدروژن 1,60 آنگستروم اندازه گیری شده است.
خواص فیزیکی آلکینها
خواص فیزیکی آلکینها ، مشابه آلکنهای هم کربن است. آلکینها ، ترکیباتی با قطبیت کمتر میباشند که در حلالهای با قطبیت کمتر مثل تتراکلرید کربن ، بنزن و اترها بخوبی حل میشوند، ولی در آب نامحلولند. همانند سایر هیدروکربنها سبکتر از آب هستند. بررسی و مقایسه نقطه ذوب و جوش این مواد نشان میدهد که با افزایش تعداد کربن نقطه جوش افزایش مییابد و با شاخهدار شدن کاهش مییابد.روشهای آزمایشگاهی تهیه آلکینها
دو روش کلی برای تهیه آلکینها وجود دارد:- تبدیل یک آلکین به آلکینهای دیگر است که با تغییر و بزرگ کردن آلکینهای کوچک امکانپذیر میباشد.
- ایجاد پیوند سه گانه کربن- کربن در مولکول میباشد که با انجام واکنشهای شیمیایی مناسب انجام پذیر میباشد.
روشهای صنعتی تهیه استیلن
استیلن ، کوچکترین عضو خانوده استیلنیهاست و در صنعت از اهمیت ویژه ای برخوردار است. به عنوان ماده اولیه و پیش ماده در سنتز و تهیه مواد شیمیایی مختلف مورد نیاز میباشد. از این رو ، روشهای صنعتی زیادی برای تولید انبوه این ماده ابداع شده است.- کاربید کلسیم از واکنش آهک و زغال کک و در دمای بالا (با استفاده از کوره های الکتریکی) تهیه میشود. حسن این ماده در این است که قابل نگهداری و به سهولت قابل حمل میباشد و لذا در هر جا و مکانی تهیه استیلن امکانپذیر میباشد.
CaO + 3C → C2Ca + H2O → H-C≡C-H
- از اکسید شدن جزئی و محدود متان در دمای بالا نیز استیلن در اشل صنعتی تولید میشود. با این روش صنعتی ، ضمن این که استیلن سنتز میشود، گازهای با ارزش هیدروژن و منوکسید کربن نیز تولید میشود که اهمیت سنتزی فراوان دارد (به عنوان مثال در سنتز متانول مورد استفاده قرار میگیرند).
6CH4 + O2 → 2CO + 10H2 + 2H-C≡C-H
- از اکسید شدن متان در دمای حدود 1500 درجه سانتیگراد و در مدت زمان بسیار کوتاه 0.1 ثانیه نیز استیلن و هیدرژن تولید میگردد.
2CH4 → H-C≡C-H + 3H2
+ نوشته شده در سه شنبه ۱۶ مهر ۱۳۹۲ ساعت 12:23 توسط فاضلی
|
 خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی
خلاصه فصل های شیمی پایه های اول و دوم و سوم وپیش دانشگاهی دوره متوسطه و خلاصه کتاب شیمی اول و دوم وسوم و پیش به همراه نمونه سوالات و مطالب جالب شیمی و همچنین شاخه های شیمی